1.葉綠素?zé)晒鉁y(cè)量有哪些主要技術(shù),?有沒(méi)有哪種儀器可以同時(shí)實(shí)現(xiàn)這些測(cè)量技術(shù),?
答:葉綠素?zé)晒饧夹g(shù)有三種主要測(cè)量技術(shù)路線:
1)PAM脈沖調(diào)制式葉綠素?zé)晒饧夹g(shù):測(cè)量PAM熒光淬滅動(dòng)力學(xué)曲線
2)直接激發(fā)式(非調(diào)制式)葉綠素?zé)晒饧夹g(shù):測(cè)量OJIP快速熒光誘導(dǎo)曲線
3)雙調(diào)制式葉綠素?zé)晒饧夹g(shù):時(shí)間分辨率可以達(dá)到1微秒,用于測(cè)量QA-再氧化動(dòng)力學(xué)曲線,、S-state、單周轉(zhuǎn)或多周轉(zhuǎn)飽和光閃快速熒光動(dòng)力學(xué)等
4)其它葉綠素?zé)晒鉁y(cè)量技術(shù):如激光誘導(dǎo)(LIF)葉綠素?zé)晒鉁y(cè)量,、太陽(yáng)光誘導(dǎo)葉綠素?zé)晒猓⊿olar-induced Chlorophyll Fluorescence,,SIF)測(cè)量等(參見(jiàn)本條后面介紹)
目前,能夠同時(shí)完成上述1)至3)三種熒光動(dòng)力學(xué)曲線測(cè)量的儀器只有FL6000雙調(diào)制葉綠素?zé)晒鈨x,、 FluorCam封閉式熒光成像系統(tǒng)和FKM多光譜熒光動(dòng)態(tài)顯微成像系統(tǒng),。而由于OJIP快速熒光動(dòng)力學(xué)曲線和QA-再氧化動(dòng)力學(xué)曲線對(duì)技術(shù)的特殊要求,對(duì)這兩種曲線的成像分析更是只有FluorCam封閉式熒光成像系統(tǒng)和FKM多光譜熒光動(dòng)態(tài)顯微成像系統(tǒng)能夠?qū)崿F(xiàn),。

左圖: FL6000雙調(diào)制葉綠素?zé)晒鈨x,;中圖:FluorCam封閉式熒光成像系統(tǒng);右圖:FKM多光譜熒光動(dòng)態(tài)顯微成像系統(tǒng)
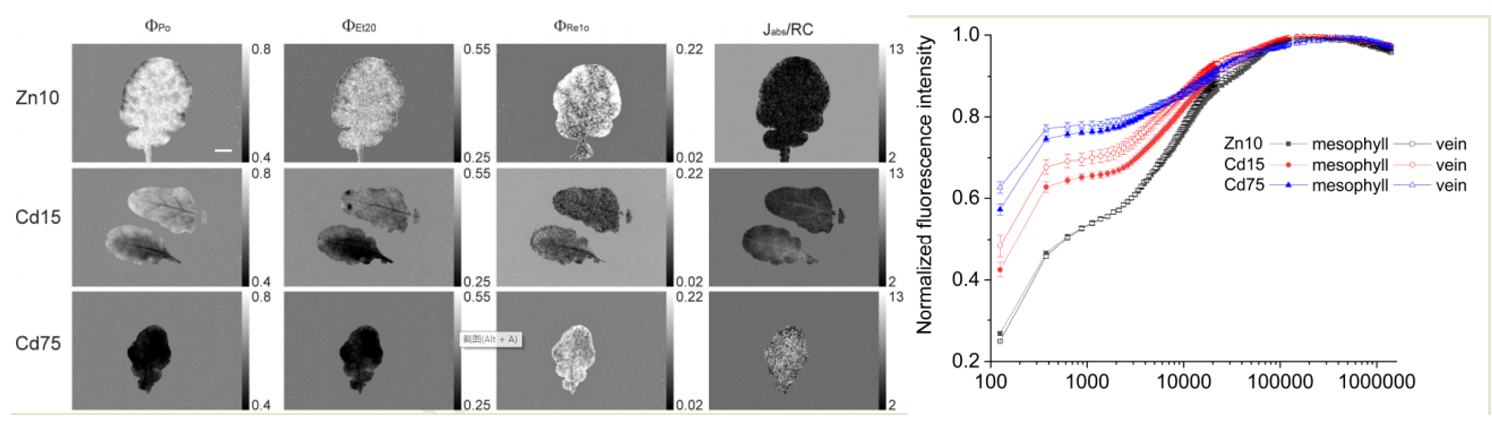
超積累植物鼠耳芥在Cd/Zn處理后的OJIP成像圖與OJIP動(dòng)力學(xué)曲線(Morina, 2020)

超積累植物鼠耳芥在Cd/Zn處理后的PAM熒光淬滅顯微成像圖與QA-再氧化動(dòng)力學(xué)分析(Morina, 2020)
易科泰生態(tài)技術(shù)公司提供葉綠素?zé)晒饧夹g(shù)全面解決方案,,除傳統(tǒng)的PAM技術(shù),、OJIP測(cè)量技術(shù)、雙調(diào)制技術(shù)外,,還提供葉綠素?zé)晒飧吖庾V成像和激光誘導(dǎo)(LIF)葉綠素?zé)晒飧吖庾V成像技術(shù)方案,,不僅可以解析植物葉綠素?zé)晒舛S異質(zhì)性分布,還進(jìn)一步從高光譜緯度解析葉綠素?zé)晒夤庾V特性,,并成像分析Fr(葉綠素?zé)晒饧t色峰值),、Ffr(葉綠素?zé)晒膺h(yuǎn)紅峰值)、Fr/Ffr,、F735/F700(與葉綠素濃度呈直線相關(guān))及基于葉綠素?zé)晒獠煌逯担t色峰值Fr和遠(yuǎn)紅峰值Ffr等)的葉綠素?zé)晒鈪?shù),。LIF葉綠素?zé)晒飧吖庾V成像技術(shù)可實(shí)現(xiàn)大田葉綠素?zé)晒饨剡b感測(cè)量。
左圖:葉綠素?zé)晒鈪?shù)Fr/Ffr成像,;右圖:葉綠素?zé)晒夤庾V(易科泰光譜成像與無(wú)人機(jī)遙感研究中心提供)
2.測(cè)量葉綠素?zé)晒獾墓庠礊槭裁醋詈镁邆鋬煞N以上顏色,?什么顏色的光源最好?
答:在FluorCam葉綠素?zé)晒獬上裣到y(tǒng)中一般推薦的光源組成是這樣的:
5)測(cè)量光:紅光
6)光化光:紅光+白光或紅光+藍(lán)光
7)飽和脈沖光:白光或藍(lán)光
在脈沖調(diào)制技術(shù)中,,測(cè)量光最主要的作用是測(cè)量最小熒光F0,。而在激發(fā)F0時(shí),要求光反應(yīng)中心不產(chǎn)生電荷分離和熱耗散,。在激發(fā)葉綠素?zé)晒獾目梢?jiàn)光波段中,,紅光波長(zhǎng)最長(zhǎng),能級(jí)最低,,能夠確保葉綠素分子被激發(fā)到較低的激發(fā)態(tài),。而藍(lán)光等波長(zhǎng)較短的光在激發(fā)葉綠素?zé)晒鈺r(shí)則可能造成熱耗散。因此紅光最佳的熒光測(cè)量光源。
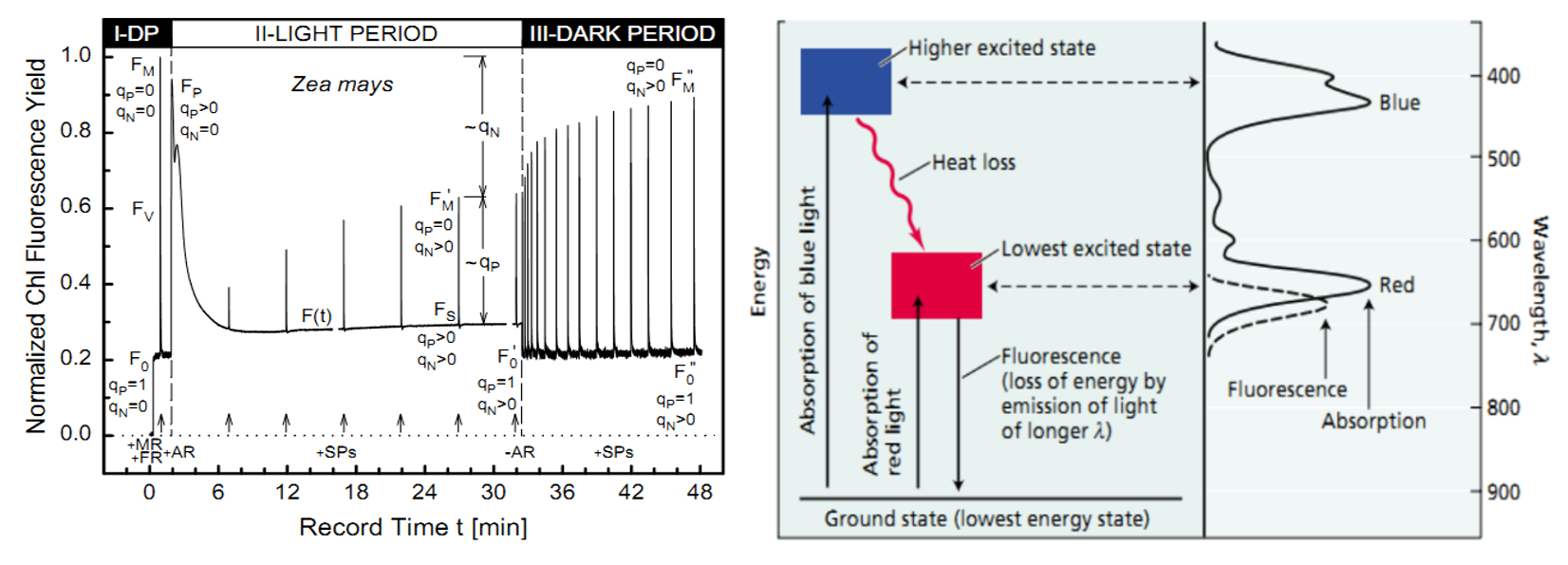
左:熒光淬滅測(cè)量過(guò)程中qN與qP的變化,;右:紅光和藍(lán)光激發(fā)葉綠素?zé)晒獾牟顒e
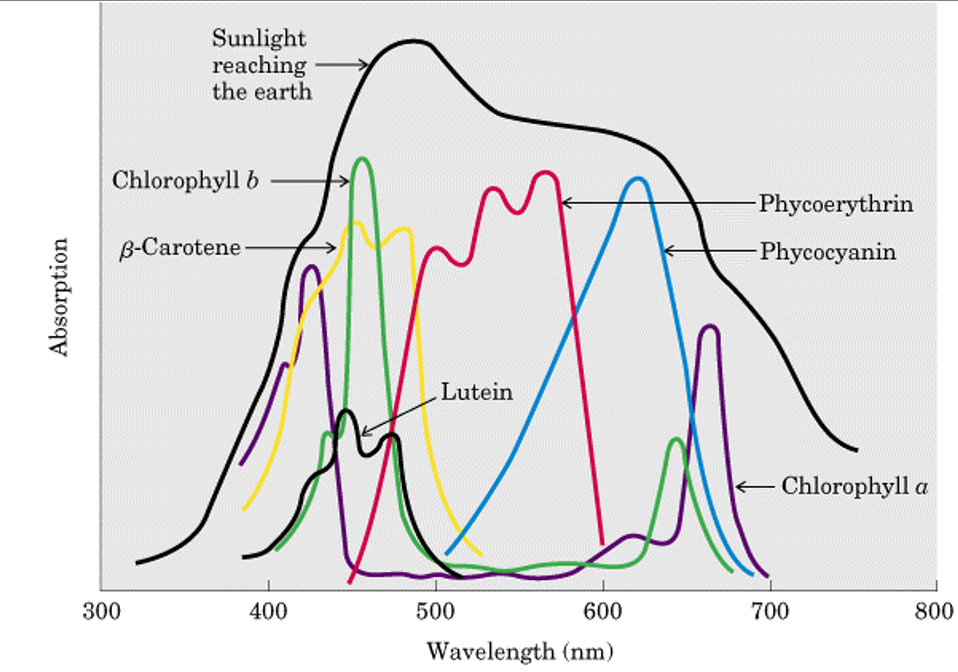
在光化光和飽和光的選擇上,,則主要考慮熒光激發(fā)效率問(wèn)題,這與植物/藻類(lèi)樣品中光合色素的吸收光譜是密切相關(guān)的,。如下圖可見(jiàn),,紅光和藍(lán)光對(duì)應(yīng)葉綠素吸收峰,激發(fā)葉綠素?zé)晒庑首罡?,也可用于研究植?藻類(lèi)對(duì)不同光質(zhì)的響應(yīng),。白光是連續(xù)光譜,可模擬自然光,,同時(shí)兼顧各種光合色素,。紅光能級(jí)較低,一般不推薦作為飽和脈沖光源,。FluorCam也可定制其他波段光源針對(duì)特定樣品,,尤其是藻類(lèi)樣品,比如590 nm琥珀光,、530nm青光,、505nm綠光等。
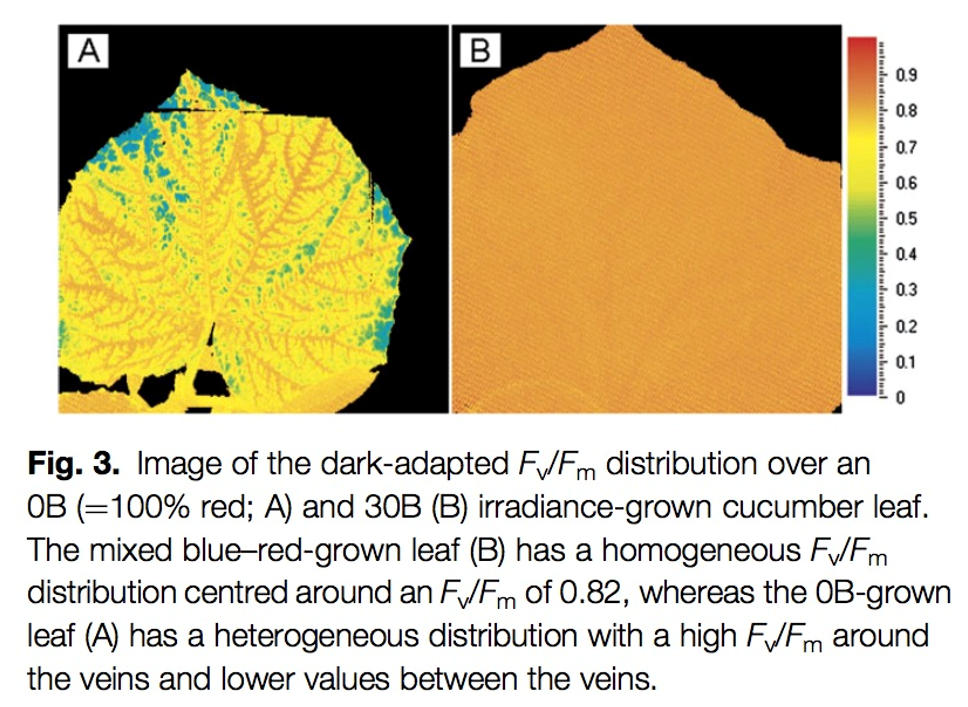
兩種或兩種以上光化學(xué)光的另一個(gè)優(yōu)勢(shì)是,,可進(jìn)行不同光質(zhì)光和效率研究及光生物學(xué)研究,,如下圖所示(引自Sander W. Hogewoning等,Blue light dose-responses of leaf photosynthesis, morphology, and chemical composition of Cucumis sativus grown under different conbinations of red and blute light. Journal of Experimental Botany, 2010)
3.FluorCam有哪些PAM脈沖調(diào)制測(cè)量功能與參數(shù),?
答:FluorCam主要的PAM脈沖調(diào)制測(cè)量功能和獲得的參數(shù)如下:
?Fv/Fm:測(cè)量參數(shù)包括F0,,F(xiàn)m,F(xiàn)v,,F(xiàn)v/ Fm等
?Kautsky誘導(dǎo)效應(yīng):F0,,F(xiàn)p,F(xiàn)v,,F(xiàn)t_Lss,,QY,,Rfd等熒光參數(shù)
?熒光淬滅分析:F0,,F(xiàn)m,F(xiàn)p,,F(xiàn)s,,F(xiàn)v,F(xiàn)v/ Fm,,QY,,F(xiàn)0’,F(xiàn)m’,F(xiàn)v’/ Fm’,,NPQ,,qP,Rfd,,qN,,qL等
?光響應(yīng)曲線:F0,F(xiàn)m,,F(xiàn)v/ Fm,,不同光強(qiáng)下QY,F(xiàn)v’/ Fm’,,NPQ,,qP,ETR等
具體參數(shù)可參閱下表:
參數(shù)符號(hào)概念描述
參數(shù)符號(hào) |
概念描述 |
Fo |
暗適應(yīng)后的最小熒光 |
Fo_Dn |
暗弛豫過(guò)程中的最小熒光,,D代表暗弛豫過(guò)程,,n代表測(cè)量過(guò)程中第n次飽和脈沖獲得的數(shù)據(jù),下同 |
Fo_Ln |
光適應(yīng)過(guò)程中的最小熒光,,L代表光適應(yīng)過(guò)程,,下同 |
Fo_Lss |
光穩(wěn)態(tài)最小熒光,ss為steady-state縮寫(xiě),,代表穩(wěn)態(tài),,下同 |
Fm |
暗適應(yīng)后的最大熒光 |
Fm_Dn |
暗弛豫過(guò)程中的最大熒光 |
Fm_Ln |
光適應(yīng)過(guò)程中的最大熒光 |
Fm_Lss |
光穩(wěn)態(tài)最大熒光 |
Fp |
光適應(yīng)過(guò)程初始階段的峰值熒光 |
Ft_Dn |
暗弛豫即時(shí)熒光 |
Ft_Ln |
光適應(yīng)即時(shí)熒光 |
Ft_Lss |
光適應(yīng)穩(wěn)態(tài)熒光 |
Fv |
暗適應(yīng)后的可變熒光,=Fm-Fo |
NPQ_Dn |
暗弛豫過(guò)程中的非光化熒光淬滅,,=(Fm-Fm_Dn)/Fm_Dn |
NPQ_Ln |
光適應(yīng)過(guò)程中的非光化熒光淬滅,,=(Fm-Fm_Ln)/Fm_Ln |
NPQ_Lss |
光穩(wěn)態(tài)非光化熒光淬滅,=(Fm-Fm_Lss)/Fm_Lss |
qP_Dn |
暗弛豫過(guò)程中的光化學(xué)熒光淬滅,,=(Fm_Dn?Ft_Dn)/Fm_Dn?Fo_Dn |
qP_Ln |
基于“Puddle”模型的光適應(yīng)過(guò)程中的光化學(xué)淬滅,,=(Fm_Ln?Ft_Ln)/(Fm_Ln?Fo_Ln) |
qP_Lss |
基于“Puddle”模型的光穩(wěn)態(tài)光適應(yīng)光化學(xué)淬滅,=(Fm_Lss?Ft_Lss)/(Fm_Lss?Fo_Lss) |
qL_Ln |
基于“Lake”模型的光適應(yīng)過(guò)程中的光化學(xué)淬滅,,=qP_ Ln×(Fo_ Ln /Ft_ Ln) |
qL_Lss |
基于“Lake”模型的光穩(wěn)態(tài)光適應(yīng)光化學(xué)淬滅,,=qP_Lss×(Fo_Lss /Ft_Lss) |
QY_Dn |
暗弛豫過(guò)程中的實(shí)際光量子效率,=(Fm_Dn?Ft_Dn)/Fm_Dn |
QY_Ln |
光適應(yīng)過(guò)程中的實(shí)際光量子效率,,=(Fm_Ln?Ft_Ln)/Fm_Ln |
QY_Lss |
光穩(wěn)態(tài)實(shí)際光量子效率,,=(Fm_Lss?Ft_Lss)/Fm_Lss |
QY_max(Fv/Fm) |
暗適應(yīng)后的最大光量子效率,=Fv/Fm |
Fv/Fm_Ln |
光適應(yīng)過(guò)程中的最大光量子效率,,=(Fm_Ln?Fo_Ln)/Fm_Ln |
Fv/Fm_Lss |
光穩(wěn)態(tài)最大光量子效率,,=(Fm_Lss?Fo_Lss)/Fm_Lss |
Rfd_Ln |
光適應(yīng)過(guò)程中的熒光衰減率,用于評(píng)估植物活力,,=(Fp?Ft_Ln)/Ft_Ln |
Rfd_Lss |
穩(wěn)態(tài)熒光衰減率,,用于評(píng)估植物活力,,=(Fp?Ft_Lss)/Ft_Lss |
ETR |
電子傳遞速率,ETR=QY_Lss×PAR×0.5×0.84(PAR吸收率),,PAR吸收率可通過(guò)PAR吸收測(cè)量模塊進(jìn)行修正 |
4.主要葉綠素?zé)晒鈪?shù)的值域范圍是多少,?相互關(guān)系是怎么樣的?
答:一般來(lái)說(shuō),,F(xiàn)m ≥ Fp ≥ Ft ≥ Fs ≥ Fo,,F(xiàn)o’ ≥ Fo,F(xiàn)m’ ≤ Fm,,暗弛豫(actinic light關(guān)閉后)的Fm ≤ 暗適應(yīng)的Fm,,F(xiàn)p和Fm’沒(méi)有嚴(yán)格高低關(guān)系。
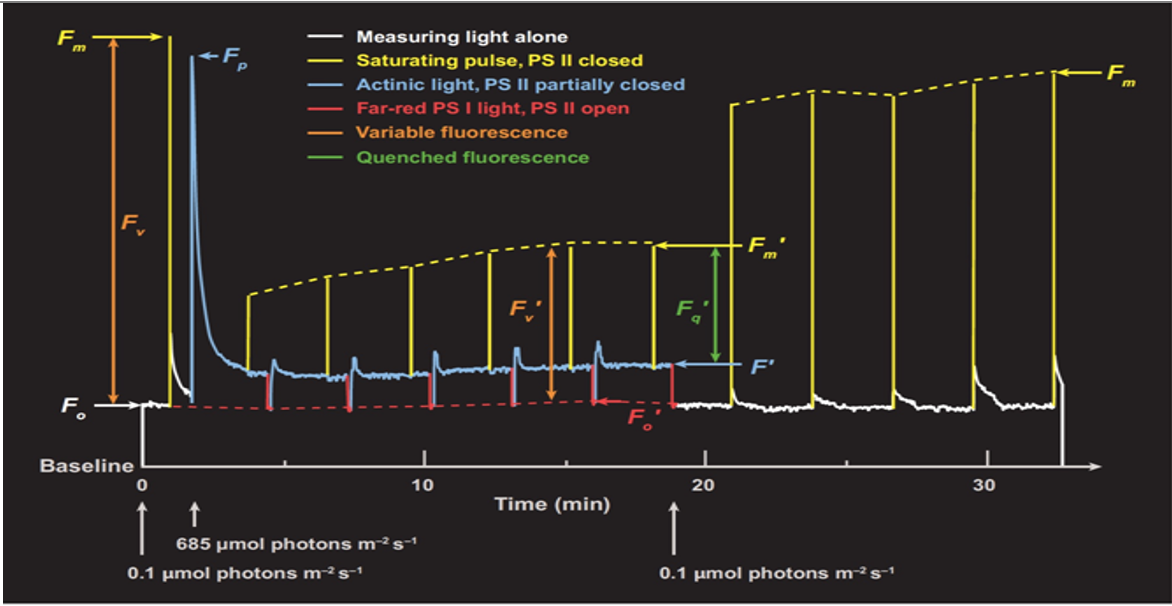
最大光化學(xué)效率Fv/Fm或QYmax值域0 – 1,。但實(shí)際上,,在理想狀況下存在上限。:
?C3植物:0.83 - 0.84 (Bjorkman and Demmig 1987)
?C4植物:0.78 (Pfundel 1998)
?藻類(lèi):常低于0.7 (Trissl and Wilhelm 1993)
這一上限在不同文獻(xiàn)中存在差異,,但一般來(lái)說(shuō),,C3植物在實(shí)驗(yàn)中對(duì)照組數(shù)據(jù)要爭(zhēng)取大于0.8,最高不能高于0.86,。
實(shí)際光化學(xué)量子效率或量子產(chǎn)額QY或ΦPSII值域0 ? 1,,≤ Fv/Fm,一般隨Actinic light升高而降低,。
Rfd值域?yàn)? ? ∞ ,,一般在0 – 6。
qN,、 qP,、 qL值域?yàn)? – 1。
NPQ值域?yàn)? ? ∞,,一般在0 – 4,。因此,有的文獻(xiàn)中會(huì)使用NPQ/4這一參數(shù)來(lái)對(duì)其歸一化,。
5.FluorCam軟件中的熒光參數(shù)似乎與文獻(xiàn)中的有些差異,,一般文獻(xiàn)中使用的參數(shù)對(duì)應(yīng)FluorCam軟件中的哪個(gè)參數(shù)?
答:軟件中為了便于識(shí)別與區(qū)分,,與文獻(xiàn)中的一般描述有所差異,。一般文獻(xiàn)中提到的參數(shù)在FluorCam軟件中的顯示如下:
文獻(xiàn)中的參數(shù)FluorCam軟件中的參數(shù)
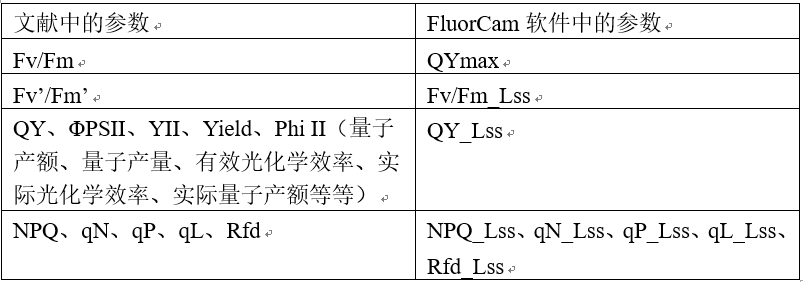
軟件參數(shù)后綴L代表光適應(yīng)過(guò)程,D代表暗弛豫過(guò)程,, ss為steady-state縮寫(xiě),,代表穩(wěn)態(tài)。Lss即為光穩(wěn)態(tài),。
對(duì)于光適應(yīng)條件下的熒光參數(shù),文獻(xiàn)中都默認(rèn)使用的是光穩(wěn)態(tài)時(shí)的對(duì)應(yīng)參數(shù)。FluorCam軟件中特別以Lss后綴加以區(qū)分,。而其他的L1,、L2、D1,、D2等對(duì)應(yīng)的參數(shù)則可以表征表示光適應(yīng)或暗弛豫從起始到穩(wěn)態(tài)的變化過(guò)程,。
在光響應(yīng)曲線Light Curve測(cè)量中,由于每一個(gè)光強(qiáng)梯度均達(dá)到光穩(wěn)態(tài),,因此參數(shù)后綴均為L(zhǎng)ss,,不同數(shù)字表示不同的光強(qiáng)梯度。
QY在中英文文獻(xiàn)中可能會(huì)有多種不同的表述方法,,但實(shí)際上其代表的意義是相同的,,即光適應(yīng)下的真實(shí)光能轉(zhuǎn)化效率,計(jì)算公式也是相同的,。
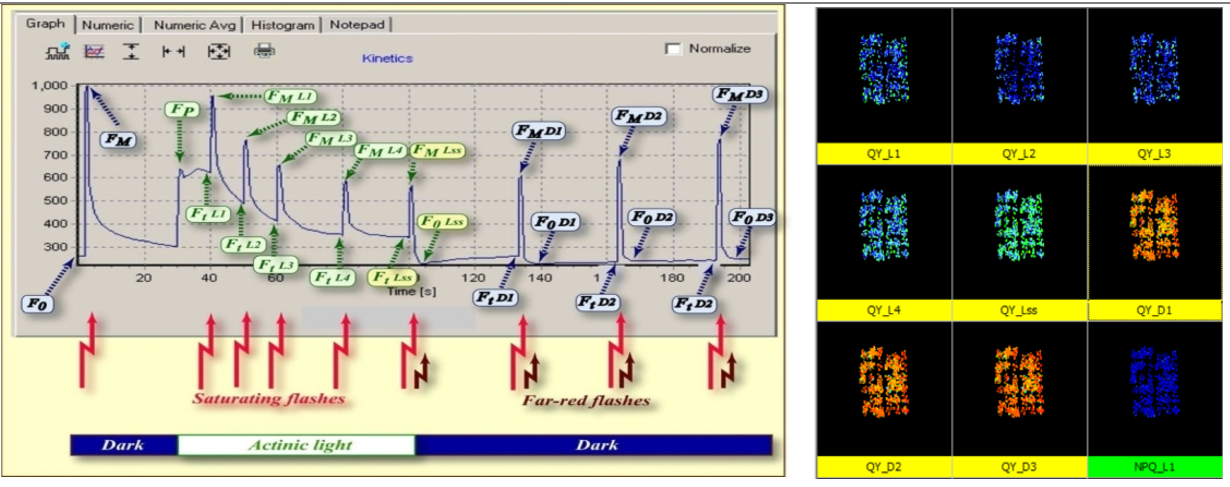
6.光適應(yīng)下的最小熒光F0’是如何測(cè)量的,?
答:最小熒光 F0是在暗適應(yīng)條件下測(cè)量得到的,這時(shí)PSII光反應(yīng)中心處于完全開(kāi)放狀態(tài)(qP=1),。而在光適應(yīng)下PSII光反應(yīng)中心處于部分關(guān)閉的狀態(tài)(0<qP<1),,這時(shí)候怎么可能測(cè)量最小熒光呢?
以前,,由于技術(shù)限制,,所有葉綠素?zé)晒鈨x器都不能直接測(cè)量F0’。1997年,,Oxborough和Baker提出了一個(gè)F0’的估算公式:
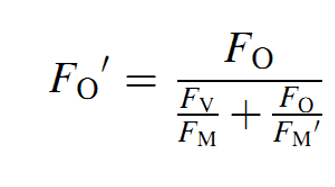
之后的一系列研究證明,,這個(gè)公式估算得到的數(shù)據(jù)是可信的。即使是現(xiàn)在,,大部分沒(méi)有明確說(shuō)明的葉綠素?zé)晒鈨x器依然是使用這個(gè)公式進(jìn)行估算,。
但這個(gè)數(shù)據(jù)終究不是直接測(cè)量得到的,在很多光合研究中是無(wú)法代表,。隨著LED技術(shù)的進(jìn)步,,F(xiàn)luorCam則通過(guò)配備專用的遠(yuǎn)紅光源板來(lái)對(duì)F0’進(jìn)行實(shí)測(cè)。這是利用了遠(yuǎn)紅光只會(huì)激發(fā)PSI而不激發(fā)PSII的特性,。在光適應(yīng)剛剛結(jié)束,,光化光關(guān)閉時(shí),立刻照射遠(yuǎn)紅光,,使PQ庫(kù)氧化,,強(qiáng)制PSII達(dá)到完全開(kāi)放的狀態(tài),從而對(duì)F0’進(jìn)行實(shí)測(cè),。
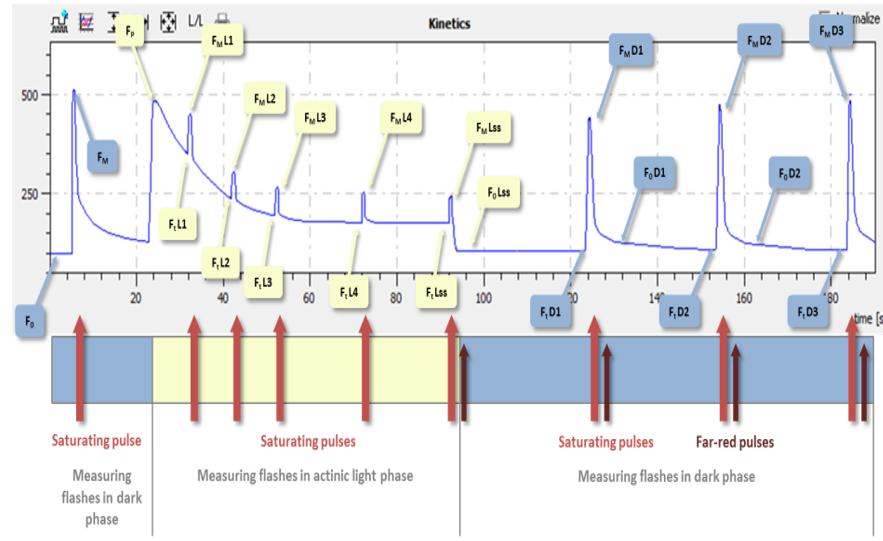
從另外一個(gè)方面說(shuō),,沒(méi)有配備遠(yuǎn)紅光源的葉綠素?zé)晒鈨x或者熒光成像儀都是不能實(shí)際測(cè)量F0’的,。同時(shí),有些熒光成像儀即使配備了遠(yuǎn)紅光源,,但由于其遠(yuǎn)紅光源沒(méi)有與PAM脈沖調(diào)制測(cè)量程序聯(lián)動(dòng),,也不能實(shí)際測(cè)量F0’。
7.葉綠素?zé)晒鉁y(cè)量前為何要進(jìn)行暗適應(yīng),?必須要進(jìn)行暗適應(yīng)嗎,?
答:暗適應(yīng)是為了測(cè)最大熒光Fm和最小熒光Fo。
植物/藻類(lèi)在經(jīng)過(guò)一定的暗適應(yīng)后,,QA最大程度被氧化,,光反應(yīng)中心完全“開(kāi)放”,此時(shí)儀器運(yùn)行程序則自動(dòng)發(fā)出測(cè)量光,,才以測(cè)得最小熒光F0,。此測(cè)量光極小,不能引起光化學(xué)反應(yīng),。也可不進(jìn)行暗適應(yīng)直接測(cè)量,,運(yùn)行Fv/Fm程序,測(cè)量得到的QYmax=QY(實(shí)際光量子效率),。
8.已經(jīng)有葉綠素?zé)晒鈨x了,,是否還有必要買(mǎi)葉綠素?zé)晒獬上駜x?
答:有必要,。葉綠素?zé)晒鈨x為點(diǎn)測(cè)量,,獲得眾多熒光參數(shù)值,單次測(cè)量難以反映樣品的整體特性,,可多次測(cè)量取平均值等,。比起熒光儀,葉綠素?zé)晒獬上駜x有以下不可替代的優(yōu)點(diǎn):
?數(shù)據(jù)結(jié)果可以是整個(gè)樣品的平均值,,可反映樣品的整體特性,,避免樣品差異造成的誤差;也可以通過(guò)ROI選區(qū)工具自動(dòng)或手動(dòng)選擇不同區(qū)域進(jìn)行分析
?成像圖能夠全面反映整株植物,、葉片,、藻類(lèi)群體等的不同位置熒光強(qiáng)度變化與分布,即光合作用生理生態(tài)及脅迫的異質(zhì)性分布狀態(tài),。
?可測(cè)量葉片,、果實(shí)、麥穗,、大型藻/微藻,、整株植物乃至植物冠層等各種樣品。
?可同時(shí)測(cè)定幾十,、甚至上百株個(gè)樣品,。
?能夠在顯微水平研究葉綠體或藻類(lèi)細(xì)胞,。
?尤其適用于環(huán)境脅迫早期植物不同部位光合活性的變化規(guī)律、突變體不同部位的光合功能差異等研究,。 
9.葉綠素?zé)晒鉁y(cè)量時(shí)如何選擇光質(zhì),?
答:葉綠素?zé)晒鉁y(cè)量主要針對(duì)葉綠素a,,葉綠素a的兩個(gè)光譜吸收波峰在藍(lán)紫光波段和紅光波段,,因此選擇藍(lán)光、紅光或者白光(復(fù)合光)一般均可,。其中注意,,藍(lán)藻測(cè)量時(shí)盡量選擇紅光。
10.葉綠素?zé)晒鉁y(cè)量必須在植物活體上測(cè)量嗎,?
答:原則上,,葉綠素?zé)晒鉁y(cè)量因盡量對(duì)樣品活體原位檢測(cè)。條件不允許時(shí)可以測(cè)量離體葉片,,但盡量在活體狀態(tài)下進(jìn)行暗適應(yīng)處理,,測(cè)試時(shí)離體時(shí)間不超過(guò)15-20分鐘。但具體情況也要看樣品在離體后失水影響的具體情況,,有些樣品則在短時(shí)離體后就會(huì)萎蔫卷曲,,如水稻,而有些樣品可耐受長(zhǎng)時(shí)間離體,,如一些革質(zhì)葉片,。離體檢測(cè)盡量使用濕紗布等包裹葉梗,如需光下轉(zhuǎn)運(yùn)可使用兩片濕濾紙夾住葉片,,避免葉片失水,,影響測(cè)量結(jié)果。
11.NPQ為負(fù)值應(yīng)當(dāng)如何解決,?
答:一般是測(cè)量參數(shù)設(shè)置不當(dāng)造成的,,可嘗試將飽和脈沖光適當(dāng)調(diào)大或光化光適當(dāng)調(diào)小。有些是樣品特性造成的,,這種情況可嘗試更換光質(zhì),。
12.是否能獲得ETR?如何獲得ETRmax,?
答:葉綠素?zé)晒鉁y(cè)量?jī)x運(yùn)行LC1~3程序,,葉綠素?zé)晒獬上襁\(yùn)行LightCurve程序,均可獲得ETR,。ETRmax則需使用sigma plot等工具軟件,,擬合光響應(yīng)曲線RLC來(lái)獲得。(參考文獻(xiàn):Ralph P J, Gademann R. Rapid light curves: A powerful tool to assess photosynthetic activity[J]. Aquatic Botany, 2005,82(3):222-237. 更多參考文獻(xiàn)可聯(lián)系易科泰獲?。?/span>
13.葉綠素?zé)晒獬上駮r(shí)對(duì)樣品有何要求,?
答:要求樣品無(wú)任何遮擋,,盡量平鋪,整株植物成像則最好對(duì)同一水平高度的部分進(jìn)行檢測(cè),。大型藻可有水濕潤(rùn)但水不要沒(méi)過(guò)樣品,。背景盡量單純并且為黑色或者非反光材質(zhì)。避免使用錫紙,、塑料板等反光物品,。測(cè)量時(shí)一般選用葉片正面,而當(dāng)葉片背面首先遭受病蟲(chóng)害時(shí),,則也可對(duì)背面進(jìn)行檢測(cè),。
14.我的不同處理組樣品是分開(kāi)成像的,那在寫(xiě)論文時(shí)如何將圖片放在一起對(duì)比,?
答:屬于同一實(shí)驗(yàn)且需要保存的成像圖,,必須將其彩色標(biāo)尺調(diào)整為相同的區(qū)間。具體步驟如下:
1)點(diǎn)選軟件result界面右下方Group color前√ ,,同一類(lèi)參數(shù)將使用同一彩色標(biāo)尺,。
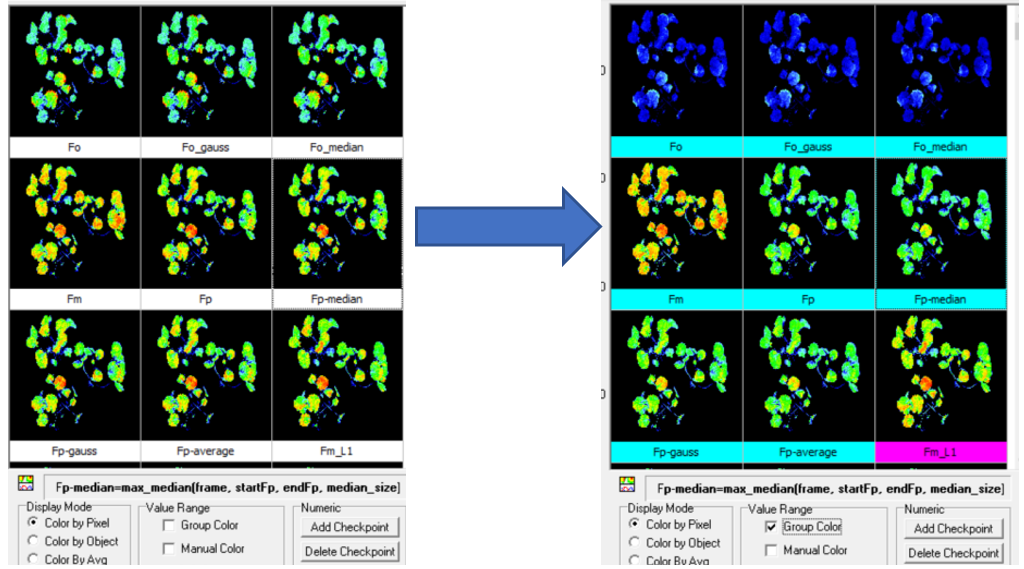
2)點(diǎn)選右下方Manual color前√ ,手動(dòng)設(shè)定標(biāo)尺范圍,,右鍵保存成像圖,。
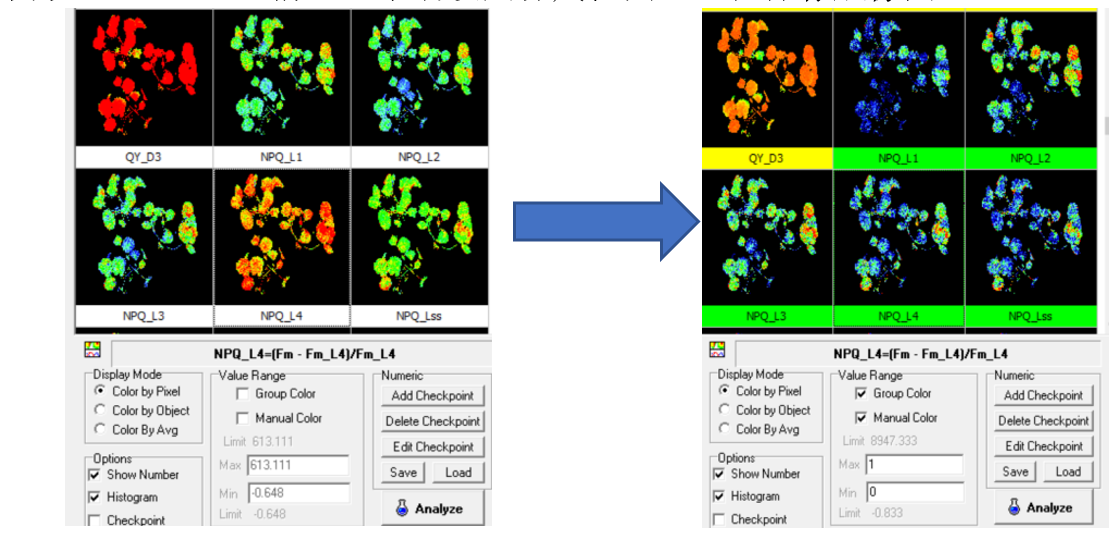
3)不同處理樣品重復(fù)以上步驟,所有樣品同一參數(shù)的成圖像標(biāo)尺范圍必須設(shè)定一致,。
4)設(shè)定標(biāo)尺范圍的標(biāo)準(zhǔn):符合對(duì)應(yīng)參數(shù)的理論范圍,,比如Fv/Fm、QY不超過(guò)0-1,,NPQ一般不超過(guò)0-4等,;為了突出成像效果,可縮小標(biāo)尺范圍,,但要確保成像圖上主要的像素點(diǎn)在這一范圍內(nèi)
15.可以通過(guò)FluorCam評(píng)估葉綠素濃度嗎,?
答:有三種方法可以評(píng)估葉綠素濃度:
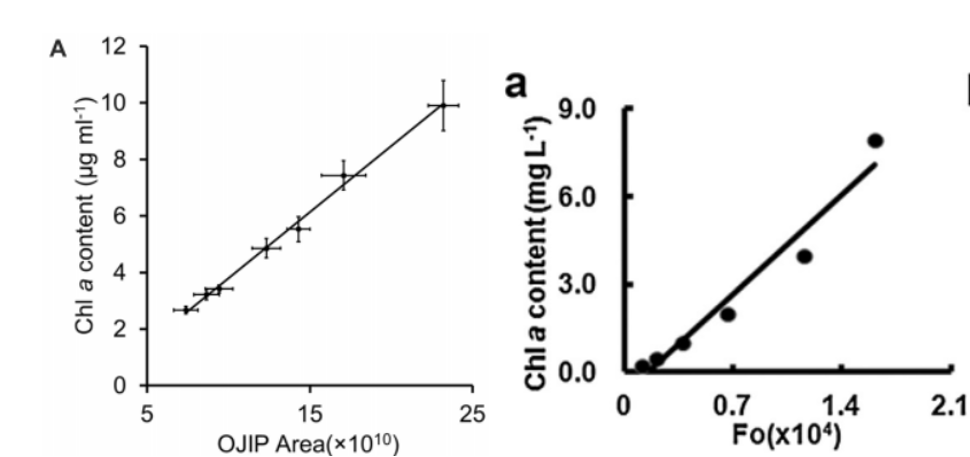
1)最小熒光F0、最大熒光Fm和OJIP快速熒光參數(shù)Area都與葉綠素濃度有正相關(guān)性,,有很多相關(guān)的文獻(xiàn)進(jìn)行過(guò)探討(Chen,,2021,2017),。但由于葉綠素?zé)晒鈪?shù)同時(shí)與光合狀態(tài)有關(guān),,因此在使用上應(yīng)小心。
2)通過(guò)PAR吸收模塊實(shí)現(xiàn),。通過(guò)這個(gè)模塊測(cè)量計(jì)算的NDVI植被歸一化指數(shù),,與葉綠素濃度成正相關(guān),這一參數(shù)本身就廣泛用于大田遙感普查、森林生態(tài)監(jiān)測(cè)等,。同時(shí)成像圖能夠反映葉綠素濃度異質(zhì)性,。

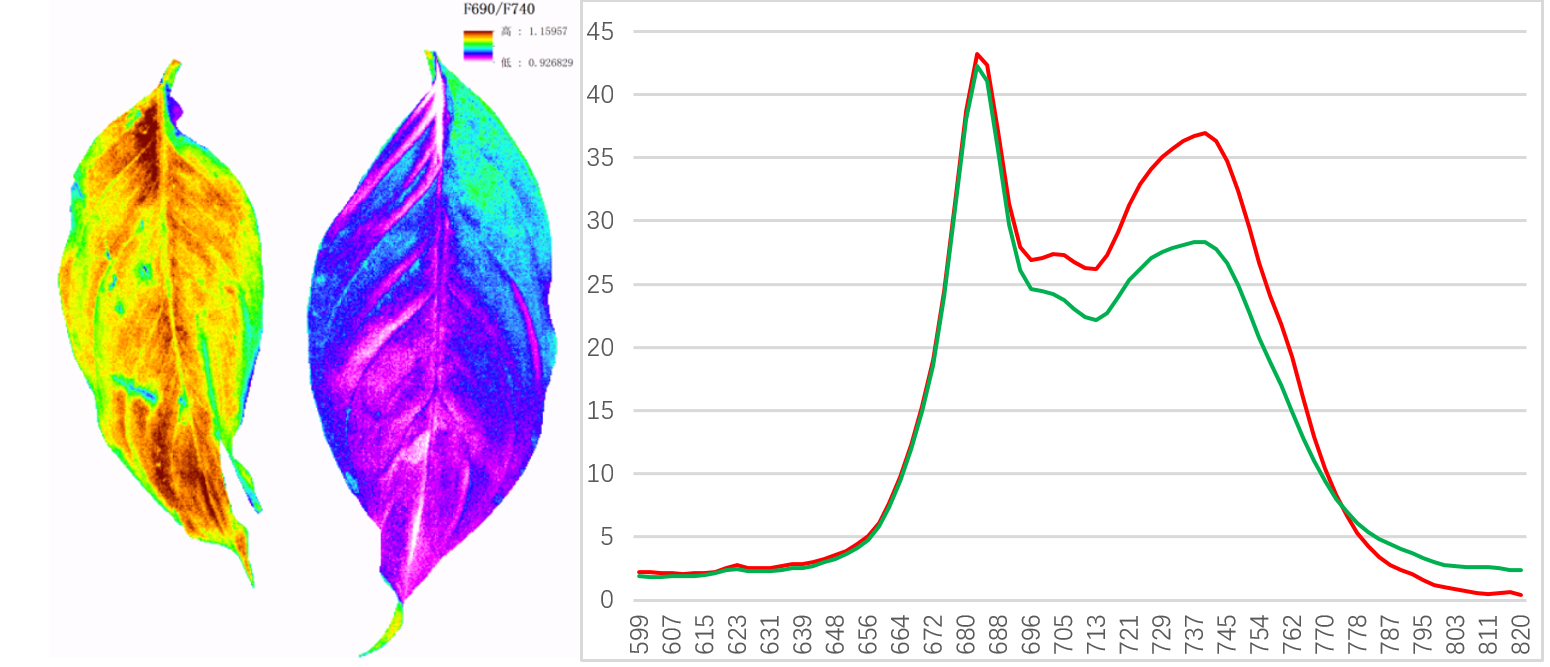
3)通過(guò)紫外激發(fā)多光譜熒光成像實(shí)現(xiàn)。測(cè)量的F690/F740與葉綠素濃度為負(fù)相關(guān),。目前已有研究其用于作物氮素營(yíng)養(yǎng)狀況評(píng)估,。
浙江大學(xué)應(yīng)用FluorCam多光譜熒光成像技術(shù)進(jìn)行油菜氮素營(yíng)養(yǎng)快速評(píng)估(Sun,2020)
16.在使用FluorCam軟件導(dǎo)出數(shù)據(jù)時(shí),,使用Frame numeric還是 numeric average更好,?
答:通常,我們建議使用numeric average,。以計(jì)算Fv/Fm為例,,F(xiàn)rame numeric是指先計(jì)算每個(gè)像素的Fv/Fm,,然后再除以像素?cái)?shù)求得區(qū)域平均Fv/Fm,。而numeric average,則是先獲得整個(gè)區(qū)域的平均F0,、平均Fm,,再以此計(jì)算Fv/Fm。如果分析過(guò)程中,,樣本信號(hào)強(qiáng),,噪點(diǎn)很少,兩種方式的差異不明顯,。如果樣本熒光信號(hào)弱,,并且存在噪點(diǎn),則選擇numeric average更好,。
17.FluorCam顯示pixels overflow是什么意思,?對(duì)數(shù)據(jù)有何影響?怎么修正,?
答:高靈敏度CCD相機(jī)檢測(cè)熒光的范圍為0-4096個(gè)單位,,高分辨率CCD相機(jī)則在0-65536。超出該信號(hào)就會(huì)警示pixels overflow即信號(hào)溢出,。在開(kāi)始實(shí)驗(yàn)測(cè)量前,,您需要在live窗口調(diào)整shutter和sensitivity,以及設(shè)置適合的光強(qiáng),。在打開(kāi)flash情況下調(diào)整shutter和sensitivity使暗適應(yīng)后的樣品熒光值處于較低數(shù)值(此時(shí)顯示的熒光值其實(shí)F0),。我們通常建議高靈敏度CCD相機(jī)設(shè)置到500-1000,高分辨率CCD相機(jī)設(shè)置到5000-10000,。不同的植物需要不同的設(shè)置,,建議預(yù)實(shí)驗(yàn)摸索。
18.Shutter和sensitivity如何影響成像質(zhì)量,?為了獲得最佳效果,,建議哪些組合設(shè)置,?
答:詳細(xì)的設(shè)置方法參考說(shuō)明書(shū)。簡(jiǎn)短來(lái)說(shuō),,shutter即快門(mén)時(shí)間,,同時(shí)還控制測(cè)量光的持續(xù)時(shí)間,一般不超過(guò)20或30ms ,,sensitivity即靈敏度,。兩者越高,熒光信號(hào)值越高,,太高則超出正常F0的范圍,。Shutter一般建議設(shè)置10-20us,最大不超過(guò)33us,。Sensitivity越高信噪比越低,,建議一般不超過(guò)50%。
19.鹽脅迫水稻幼苗非光化學(xué)熒光淬滅成像:視頻中動(dòng)力學(xué)曲線隨著脅迫加重而上升說(shuō)明了什么,,還有怎么去分析此類(lèi)型的動(dòng)力學(xué)曲線,?
答:動(dòng)力學(xué)曲線隨脅迫加重上升一般是因?yàn)槊{迫導(dǎo)致PSII光化學(xué)反應(yīng)活性降低,光能轉(zhuǎn)化效率低,,更多的光能以熒光的形式散失,,所以導(dǎo)致熒光信號(hào)增強(qiáng)。
熒光動(dòng)力學(xué)曲線的分析通常有兩種方式:一是比較不同樣品在暗適應(yīng)-光適應(yīng)-暗弛豫3個(gè)階段的熒光強(qiáng)度變化的差異,,考察PSII對(duì)光強(qiáng)變化的適應(yīng)性和可塑性以及每個(gè)階段的PSII的活性及電子傳遞狀況,。分析結(jié)果都是定性描述,定量分析仍需借助計(jì)算值,;另外一種分析方式是將動(dòng)力學(xué)曲線上的特征性熒光強(qiáng)度(如Fm_Ln,,n代表第幾次脈沖)作為變量,和計(jì)算值(如Fv/Fm)一起輸入到數(shù)學(xué)模型中,,從而篩選出能夠反映脅迫程度的特征參數(shù),。后者可參考以下論文:
龍燕, 馬敏娟, 王英允,等. 利用葉綠素?zé)晒鈩?dòng)力學(xué)參數(shù)識(shí)別苗期番茄干旱脅迫狀態(tài)[J]. 農(nóng)業(yè)工程學(xué)報(bào), 2021, 37(11):8.
20.葉綠素?zé)晒鉁y(cè)量技術(shù)與光合儀的區(qū)別?
答:兩者都是研究植物和藻類(lèi)光合作用的有效工具,,但是側(cè)重不同,。
光合儀主要測(cè)量植物的宏觀參數(shù),如光合速率,、蒸騰速率,、氣孔導(dǎo)度、胞間CO2濃度等,,以評(píng)估衡量植物光合作用的強(qiáng)度和能力,,并標(biāo)配或可選配微氣候控制如光、溫、濕,、CO2模塊,。
葉綠素?zé)晒獠粌H能反映光能吸收、激發(fā)能傳遞和光化學(xué)反應(yīng)等光合作用的原初反應(yīng)過(guò)程,,而且與電子傳遞,、質(zhì)子梯度的建立及ATP合成和CO2固定等過(guò)程有關(guān),是研究植物光合作用的“探針”,。
兩者結(jié)合測(cè)量在植物光合生理研究中可以有效互補(bǔ),,可廣泛應(yīng)用于衡量植物生長(zhǎng)狀況,不同脅迫處理對(duì)植物光系統(tǒng)的影響,,評(píng)價(jià)生態(tài)系統(tǒng)碳收支與全球氣候變化的相互關(guān)系,,植物光系統(tǒng)對(duì)全球變化響應(yīng)等方面。
21.藍(lán)藻光合參數(shù)的測(cè)定
答:由于藍(lán)光無(wú)法激發(fā)藍(lán)藻PSII主要的天線色素藻膽素,,只能激發(fā)葉綠素,,而藍(lán)藻中PSI中的葉綠素要多于PSII,這會(huì)使PQ庫(kù)部分氧化,,所以需要選擇藍(lán)光以外的激發(fā)光源,,如UV365nm、cyan470nm,、green530nm、orange625nn,。

西安研發(fā)中心
微信公眾號(hào)

業(yè)務(wù)咨詢
張老師

易科泰公司
微信公眾號(hào)

易科泰公司
視頻號(hào)
聯(lián)系我們:
地址: 北京市海淀區(qū)高里掌路3號(hào)院6號(hào)樓1單元101B
電話: 010-82611269/1572
傳真: 010-62465844
Email: [email protected]
友情鏈接: