
時(shí)間:2020-02-17
作者:易科泰
點(diǎn)擊量:
簡(jiǎn)介:
FKM多光譜熒光動(dòng)態(tài)顯微成像系統(tǒng)

FKM(Fluorescence Kinetic Microscope)多光譜熒光動(dòng)態(tài)顯微成像系統(tǒng)是目前功能最為強(qiáng)大全面的植物顯微熒光研究?jī)x器,,是基于FluorCam葉綠素?zé)晒獬上窦夹g(shù)的顯微成像定制系統(tǒng),。它由包含可擴(kuò)展部件的增強(qiáng)顯微鏡、高分辨率CCD相機(jī),、激發(fā)光源組,、光譜儀,、控溫模塊以及相應(yīng)的控制單元和專(zhuān)用的工作站與分析軟件組成,。它不僅可以進(jìn)行微藻、單個(gè)細(xì)胞,、單個(gè)葉綠體乃至基粒-基質(zhì)類(lèi)囊體片段進(jìn)行Fv/Fm,、Kautsky誘導(dǎo)效應(yīng)、熒光淬滅,、OJIP快速熒光響應(yīng)曲線,、QA再氧化等各種葉綠素?zé)晒饧癕CF多光譜熒光(multicolor fluorescence)成像分析,;還能通過(guò)激發(fā)光源組進(jìn)行進(jìn)行任意熒光激發(fā)和熒光釋放波段的測(cè)量,從而進(jìn)行GFP,、DAPI,、DiBAC4、SYTOX,、CTC等熒光蛋白、熒光染料以及藻青蛋白,、藻紅蛋白,、藻膽素等藻類(lèi)特有熒光色素的成像分析;更可以利用光譜儀對(duì)各種熒光進(jìn)行光譜分析,,區(qū)分各發(fā)色團(tuán)(例如PSI和PSII及各種捕光色素復(fù)合體等)并進(jìn)行深入分析,。
FKM多光譜熒光動(dòng)態(tài)顯微成像系統(tǒng)使熒光成像技術(shù)真正成為光合作用機(jī)理研究的探針,使科研工作者在藻類(lèi)和高等植物細(xì)胞與亞細(xì)胞層次深入理解光合作用過(guò)程及該過(guò)程中發(fā)生的各種變化,,為直接研究葉綠體中光合系統(tǒng)的工作機(jī)理提供了最為有力的工具,。FKM作為藻類(lèi)/植物表型和基因型顯微研究的雙重利器,得到了學(xué)界的廣泛認(rèn)可并取得了大量的科研成果,。
功能特點(diǎn)

應(yīng)用領(lǐng)域

測(cè)量樣品
工作原理
FKM分析過(guò)程中,,通過(guò)連接在顯微鏡上的激發(fā)光源組和內(nèi)置在6位濾波輪中的一系列濾波器、分光鏡激發(fā)植物樣品中各種發(fā)色團(tuán)的動(dòng)態(tài)熒光,。樣品激發(fā)出的熒光經(jīng)顯微鏡放大后進(jìn)行熒光光譜分析和熒光動(dòng)力學(xué)成像分析,。SM 9000光譜儀通過(guò)光纖與顯微鏡連接,以進(jìn)行激發(fā)熒光光譜分析,。安裝在顯微鏡頂部的高分辨率CCD相機(jī)則用于熒光動(dòng)力學(xué)成像分析,。全部工作過(guò)程通過(guò)工作站和控制單元按照預(yù)先設(shè)定好的程序自動(dòng)進(jìn)行。測(cè)量過(guò)程中,,可通過(guò)溫控模塊調(diào)控藻類(lèi),、植物細(xì)胞等實(shí)驗(yàn)樣品的溫度。蠕動(dòng)泵可以實(shí)現(xiàn)培養(yǎng)藻類(lèi)的連續(xù)測(cè)量,。
儀器組成
1 增強(qiáng)顯微鏡
2 高分辨率CCD相機(jī)
3 激發(fā)光源組
4 SM 9000光譜儀
5 主控制單元
6 工作站及軟件
7 控溫模塊的控制單元
8 位濾波輪

技術(shù)參數(shù)
測(cè)量參數(shù)
具備完備的自動(dòng)測(cè)量程序(protocol),,可自由對(duì)自動(dòng)測(cè)量程序進(jìn)行編輯
熒光激發(fā)光源:
透射光源(選配):白光、遠(yuǎn)紅光
高分辨率TOMI-2 CCD傳感器:
顯微鏡:Axio Imager M2,,可選配Axio Scope A1簡(jiǎn)潔版或Axio Imager Z2高級(jí)版
物鏡:10倍、20倍,、40倍,、63倍和100倍專(zhuān)用生物熒光物鏡(可選)
6位濾波輪:葉綠素?zé)晒狻FP/SYTOX,、DAPI/CTC等
SM9000光譜儀
溫度調(diào)控模塊:溫度調(diào)節(jié)范圍為環(huán)境溫度(室內(nèi)溫度)至70℃,,精確度0.1℃
蠕動(dòng)泵(選配):流速10-5600μl/min,用于藻類(lèi)連續(xù)培養(yǎng)測(cè)量
FluorCam葉綠素?zé)晒獬上穹治鲕浖δ埽壕週ive(實(shí)況測(cè)試),、Protocols(實(shí)驗(yàn)程序選擇定制),、Pre–processing(成像預(yù)處理)、Result(成像分析結(jié)果)等功能菜單
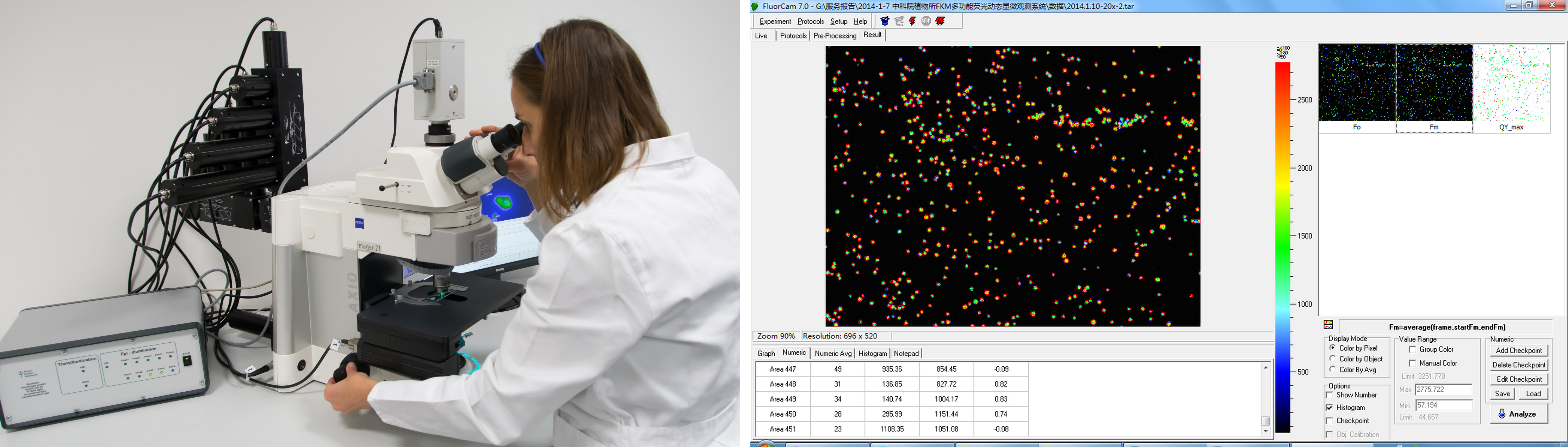
葉綠素?zé)晒馀c光譜分析結(jié)果
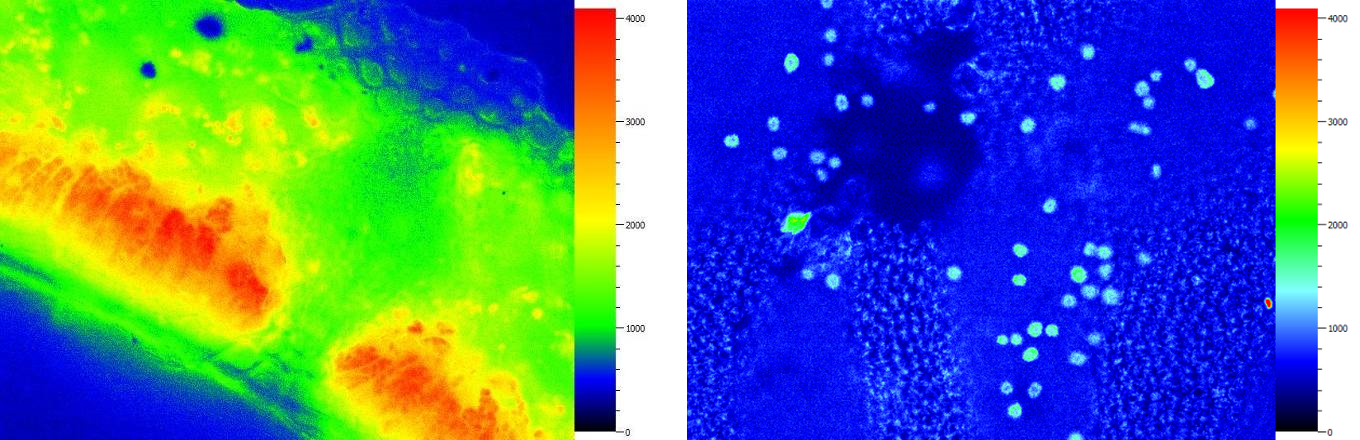
忍冬葉片橫切熒光成像——柵欄組織和海綿組織 硅藻附生的紫菜表面熒光成像——細(xì)胞內(nèi)的葉綠體分布

鳶尾表皮細(xì)胞熒光成像——?dú)饪着c葉綠體 衣藻熒光成像
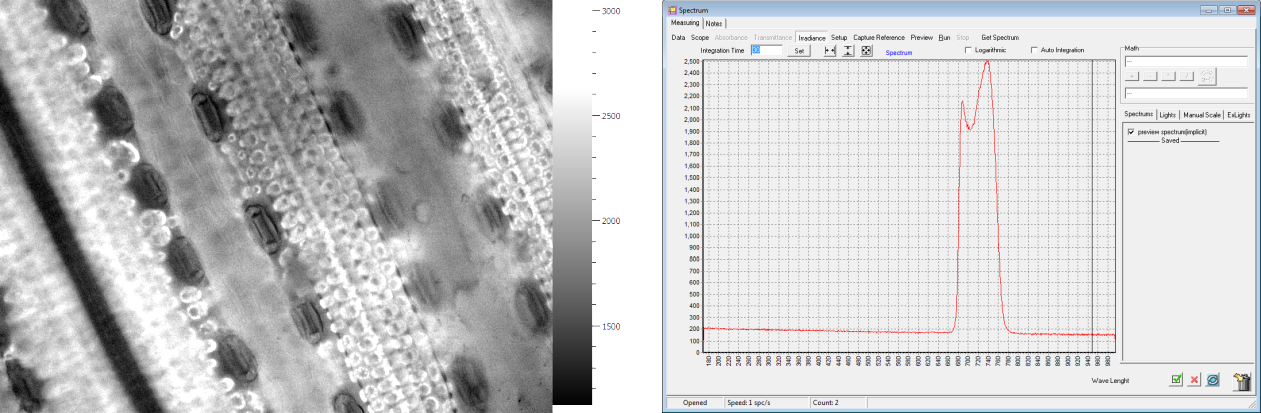
玉米表皮細(xì)胞熒光成像 葉綠素?zé)晒夤庾V分析
典型應(yīng)用
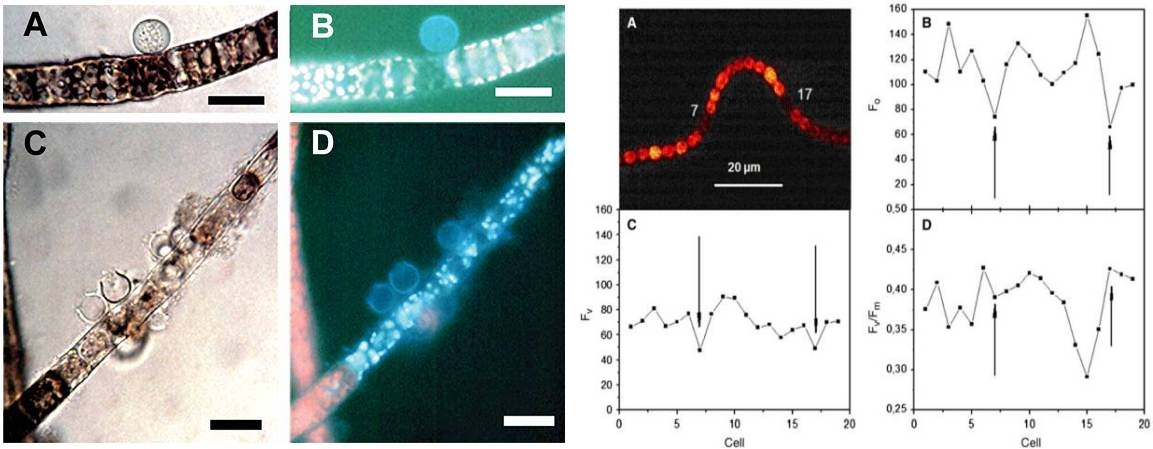
藻類(lèi)病害(Gachon C, et al. 2006) 藻類(lèi)異形胞光合生理與變化過(guò)程 (Ferimazova N, et al. 2013)
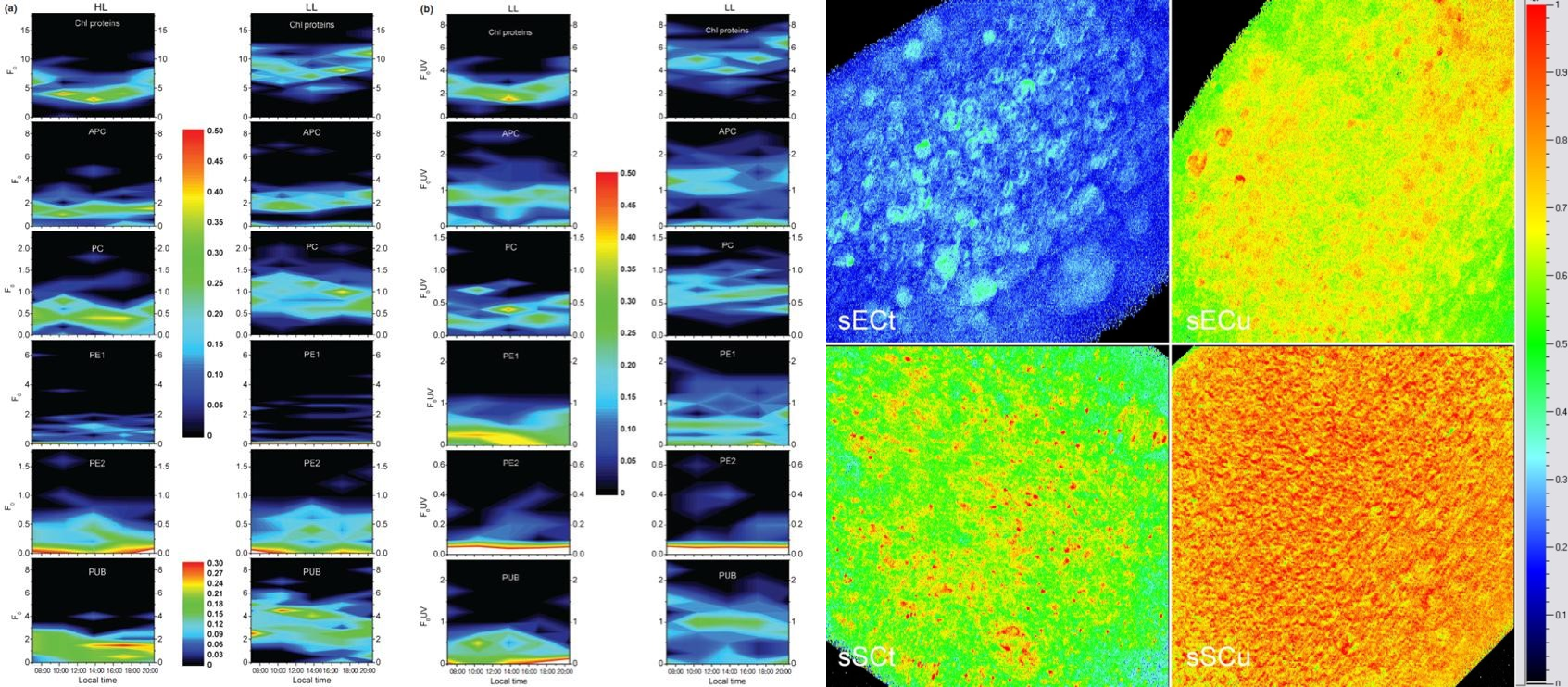
藻類(lèi)特有不同光合色素蛋白復(fù)合體的熒光成像與分析(Andresen, et al. 2010) 重金屬脅迫對(duì)藻類(lèi)/植物的影響(Thomas G, et al. 2016)
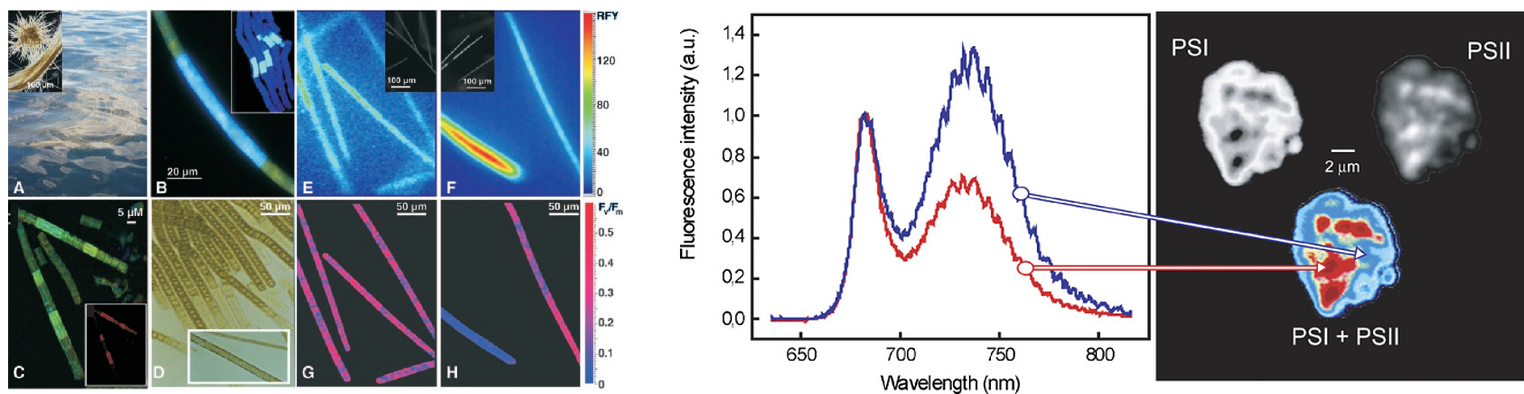
藍(lán)藻光合與固氮的時(shí)空隔離(Berman-Frank I, et al. 2001) 植物/藻類(lèi)光合作用機(jī)制的深入研究(Vacha F, et al. 2007.)
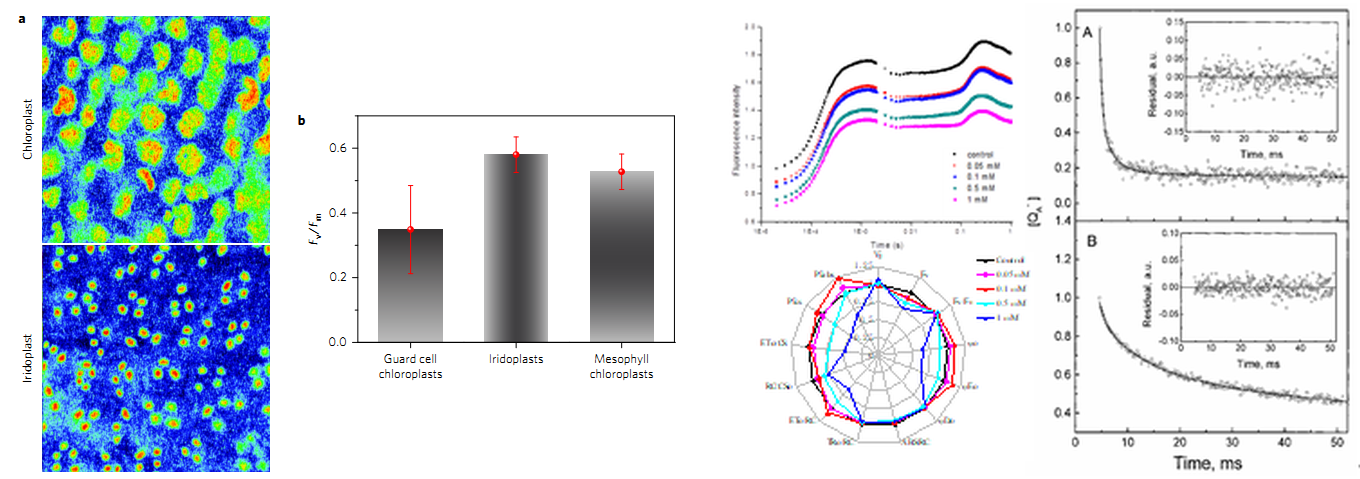
單個(gè)細(xì)胞\葉綠體熒光動(dòng)力學(xué)與表型分析(Jacobs M, et al. 2016.) OJIP快速熒光曲線和QA再氧化動(dòng)力學(xué)曲線測(cè)量
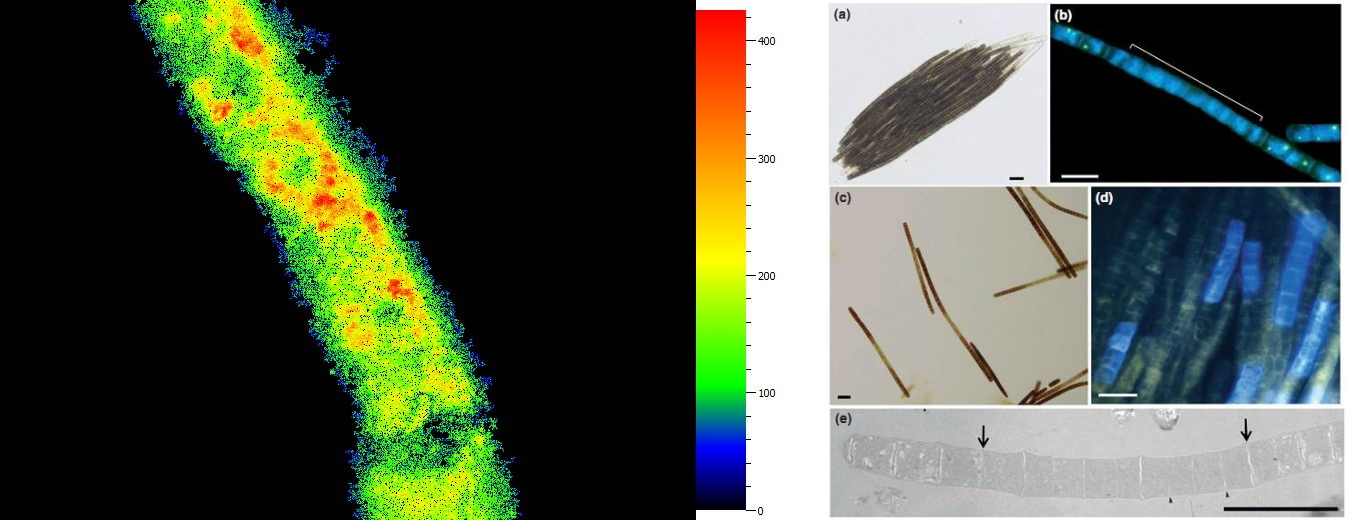
C4植物玉米花環(huán)結(jié)構(gòu)光合特性分析 熒光蛋白與熒光染料顯微成像
產(chǎn)地:捷克
參考文獻(xiàn):
1)Morina F, et al. 2021. Interactions between zinc and Phomopsis longicolla infection in the roots of Glycine max. Journal of Experimental Botany 72(8):3320-3336
2)Ashraf N, et al. 2021. Effect of nanomolar concentrations of lanthanum on Desmodesmus quadricauda cultivated under environmentally relevant conditions. Aquatic Toxicology 235: 105818
3)Umeki M, et al. 2020. Fecal pellets of giant clams as a route for transporting Symbiodiniaceae to corals. PLoS ONE 15(12): e0243087
4)Morina F, & Küpper H. 2020. Direct inhibition of photosynthesis by Cd dominates over inhibition caused by micronutrient deficiency in the Cd/Zn hyperaccumulator Arabidopsis halleri. Plant Physiology and Biochemistry. DOI:10.1016/j.plaphy.2020.07.018
5)Morina F, et al. 2020. Interaction Between Zn Deficiency, Toxicity and Turnip Yellow Mosaic Virus Infection in Noccaea ochroleucum. Frontiers in Plant Science, 11.DOI:10.3389/fpls.2020.00739
6)Wang ZX, et al. 2020. Extravagant leaves display in Actinidia kolomikta attracting pollinators and maintaining photosynthetic capacity. bioRxiv, DOI: 10.1101/2020.03.05.979500
7)劉文娟等,,2020. 兩個(gè)玉米品種維管束鞘葉綠體的非光化學(xué)淬滅對(duì)干旱脅迫的響應(yīng). 中國(guó)農(nóng)業(yè)科學(xué) 53(8): 1532-1544
8)Andresen E, et al. 2019. Chronic exposure of soybean plants to nanomolar cadmium reveals specific additional high-affinity targets of Cd toxicity. Journal of Experimental Botany. DOI:10.1093/jxb/erz530
9)Morishima SY, et al. 2019. Study on expelled but viable zooxanthellae from giant clams, with an emphasis on their potential as subsequent symbiont sources. PLOS ONE, 14(7), e0220141.
10)Kupper H, et al. 2018. Analysis of OJIP chlorophyll fluorescence kinetics and QA re-oxidation kinetics by direct fast imaging. Plant Physiology, pp.00953.2018.